- Teoria Cinética dos Gases:
* As dimensões das moléculas dos gases são muito menores do que a distância entre essas moléculas.
* As moléculas gasosas movimentam-se constantemente de maneira caótica ocupando todo o recipiente.
* As colisões das moléculas gasosas na parede do recipiente faz com que o gás exerça uma certa pressão sobre ela.
* As colisões das moléculas gasosas na parede do recipiente são perfeitamente elásticas, ou seja, não perdem energia ao colidirem.
* Quanto maior a temperatura, maior será o movimento das moléculas gasosas, ou seja, a temperatura é diretamente proporcional a velocidade da molécula gasosa.
Gás Ideal ou Gás Perfeito, é aquele gás que segue rigorosamente a teoria da cinética dos gases! A medida que se diminui a pressão e se aumenta a temperatura o gás vai se tornando ideal.
- Propriedades dos gases:
* Os gases mudam de volume quando a pressão sobre eles exercida é alterada, devido a sua propriedade elástica. Quando a pressão aumenta, o seu volume diminui.
* Como o gás é formado por um enorme espaço entre suas moléculas, ao exercer uma pressão sobre ele, você vai proporcionar uma aproximação entre essas moléculas gasosas, resultando, assim, na diminuição do volume. Isso explica a sua propriedade de compressibilidade.
* Se a parede do recipiente em que se encontra o gás diminuir, irá resultar obrigatoriamente no aumento da pressão, uma vez que os choques entre suas moléculas iram aumentar.
* O aumento da temperatura aumenta também a pressão do gás, tendo em vista que se você aumenta a temperatura, as moléculas vão possuir maior energia cinética, com isso, as colisões na parede do recipiente também aumenta, logo a pressão juntamente!
* A mistura entre gases é homogênea, ou seja, gases diferentes quando colocados juntos apresentam difusibilidade.
- Equação do Gás Ideal:
Essa equações relaciona as variáveis de um gás entre si, essas variáveis são pressão, volume, temperatura e número de mols.
* O "R" é uma constante. (R= 0,082)
* O volume deve ser expresso em litros.
- Consequências do gás ideal:
A) Princípio de Avogadro:
Volumes iguais de gases quaisquer nas CNTP apresentam o mesmo número de mol.
B) Lei volumétrica de Gay-Lussac:
Volume é diretamente proporcional ao número de mols, em que essa proporção é constante para números inteiros pequenos.
* Conservação gasosa.
* Expansão gasosa. Toda expansão gasosas pode realizar trabalho!
* Contração gasosa.
C) Lei de Boyle-Marriote
Sob a temperatura constante o volume de um gás é inversamente proporcional a sua pressão.
- Mudança de Estado:
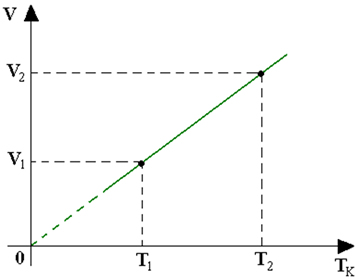
A) Isotérmica: Temperatura constante
B) Isobárica: Pressão constante
C) Isocórica: Volume constante
Equação Geral dos gases:





0 comentários:
Postar um comentário